Il decapaggio è un processo chimico grazie al quale è possibile rimuovere strati superficiali di materiale attraverso l’uso di acidi o alcali. Il decapaggio era già noto nell’antichità, quando veniva impiegato per effettuare la pulizia dei metalli al termine delle lavorazioni.
Nella seconda metà del Novecento, la comunità scientifica si è spinta verso uno sviluppo tecnologico di tipo ecosostenibile. In particolare, la diffusione di materiali plastici resistenti alla corrosione e la capacità di rigenerare gli acidi esausti hanno ricoperto un ruolo fondamentale per lo sviluppo del decapaggio.
Le fasi del processo di decapaggio
Al termine delle lavorazioni a caldo, l’acciaio può presentare delle impurità sulla superficie, quali ad esempio la ruggine e la calamina, uno strato composto da ossido ferroso (FeO), magnetite (Fe3O4) ed ematite (Fe2O3).
Questa crosta che ricopre l’acciaio deve essere dunque rimossa prima di eseguire le lavorazioni a freddo. Il decapaggio è quell’operazione chimica che consente la rimozione di tali impurità attraverso l’uso di acidi, tra questi i più utilizzati sono l’acido solforico (H2SO4) e l’acido cloridrico (HCl). In Figura 1, si mostrano gli elementi coinvolti nel processo. Nella presente trattazione, si vedrà il caso dell’acido solforico.
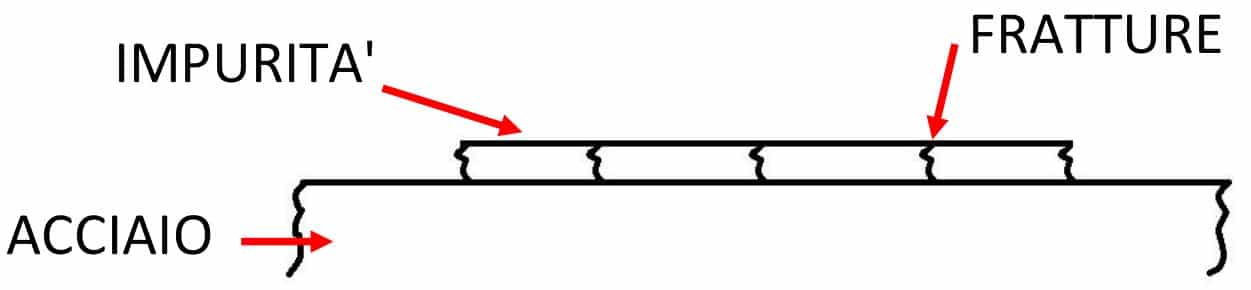
Fig. 1 – Elementi coinvolti durante il decapaggio
Per comprendere il decapaggio occorre analizzare le reazioni chimiche che hanno luogo durante l’operazione. Esse sono le seguenti:

In particolare, affinché le reazioni possano avvenire, è necessario che l’acido solforico si presenti in soluzione acquosa. In entrambe le equazioni uno dei prodotti è il solfato ferroso. La prima reazione tuttavia è più lenta e, per lo scopo del presente articolo, può essere trascurata.
Il prodotto che consente la rimozione delle impurità si trova nella seconda equazione ed è l’idrogeno. Andiamo ora a vedere le fasi principali del decapaggio (illustrate sinteticamente in Figura 2):
• l’acciaio viene immerso all’interno di una vasca contenente l’acido
• l’acido raggiunge lo strato superficiale dell’acciaio attraverso delle fratture e inizia a reagire con il Ferro (Fe)
• l’idrogeno emerge sotto forma di bolle allentando la crosta superficiale composta dalle impurità
• la reazione esotermica rilascia del calore
• le croste cominciano a cedere e a staccarsi dall’acciaio per effetto delle bolle di idrogeno
• il numero di bolle di idrogeno che si vengono a formare sotto lo strato da rimuovere cresce
• la quantità di acido libero diminuisce gradualmente per effetto delle reazioni
• la presenza del solfato ferroso inizia ad essere visibile (si distingue facilmente perché di colore verde)
• la crosta viene rimossa poco per volta e si deposita sul fondo
• le bolle di idrogeno formate dopo la rimozione totale della crosta producono il fenomeno dell’effervescenza
• la soluzione emana un odore acre
• l’acciaio assume un colore luccicante.
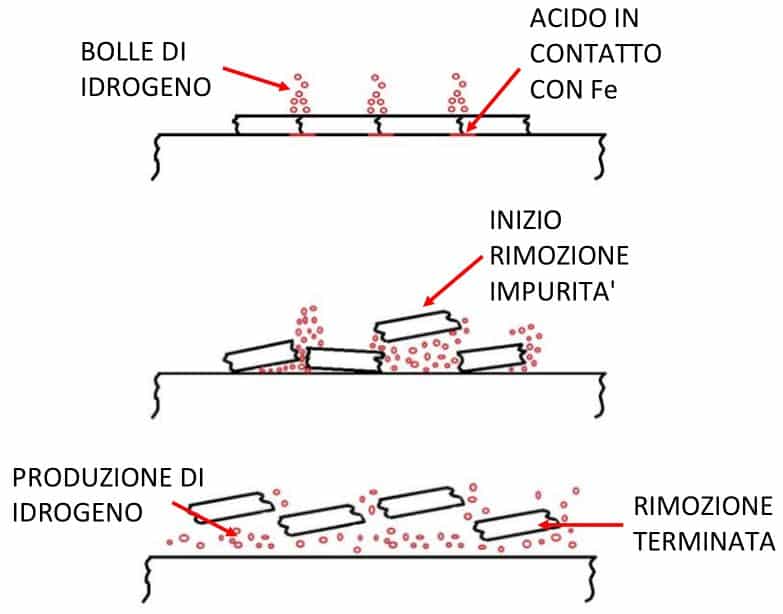
Figura 2 – Principali fasi del decapaggio
Occorre inoltre precisare che lo scopo dell’operazione è rimuovere unicamente lo strato di impurità: l’acido solforico non deve reagire con l’intera superficie esposta dell’acciaio, ma soltanto con la parte sottostante la crosta. A tale scopo si introducono, spesso con procedure trial and error, degli inibitori, ossia delle sostanze in grado di rallentare o impedire una reazione chimica.
Si può inoltre dimostrare che la velocità di rimozione delle impurità cresce all’aumentare della temperatura. Il calore rilasciato dalla reazione non è tuttavia sufficiente a garantire il mantenimento della temperatura di riferimento poiché sono presenti numerose fonti di perdita di calore (temperatura ambiente che circonda il contenitore, materiale entrante nella vasca, evaporazione etc.). Per questo motivo, si rende necessario l’uso di sistemi di controllo della temperatura.
Introducendo ora altro acciaio all’interno della vasca si registrerebbe un decremento delle prestazioni in termini di velocità di rimozione del materiale. L’equazione chimica mostra infatti la riduzione graduale dell’acido solforico e la formazione del solfato ferroso: al diminuire del primo, il secondo aumenta e il decapaggio è sempre meno efficace. Occorre dunque introdurre ulteriore acido all’interno della soluzione per continuare l’operazione.
Allo stesso tempo, il solfato ferroso è un sale ed in quanto tale ha una solubilità limitata in acqua, oltre tale valore il solfato ferroso inizia un processo di cristallizzazione che rende il decapaggio sempre meno efficace. In conclusione, non è possibile continuare ad aggiungere acido alla soluzione all’infinito. Dunque, prima che il processo di cristallizzazione abbia inizio, è necessario pompare l’acido esausto in un sistema di rigenerazione.
Dopo aver eliminato le impurità superficiali è necessario risciacquare l’acciaio in modo da rimuovere ogni residuo di acido. In seguito, sarà possibile procedere con ulteriori lavorazioni.
Le fasi salienti qui descritte sono illustrate nello schema a blocchi riportato in Figura 3.
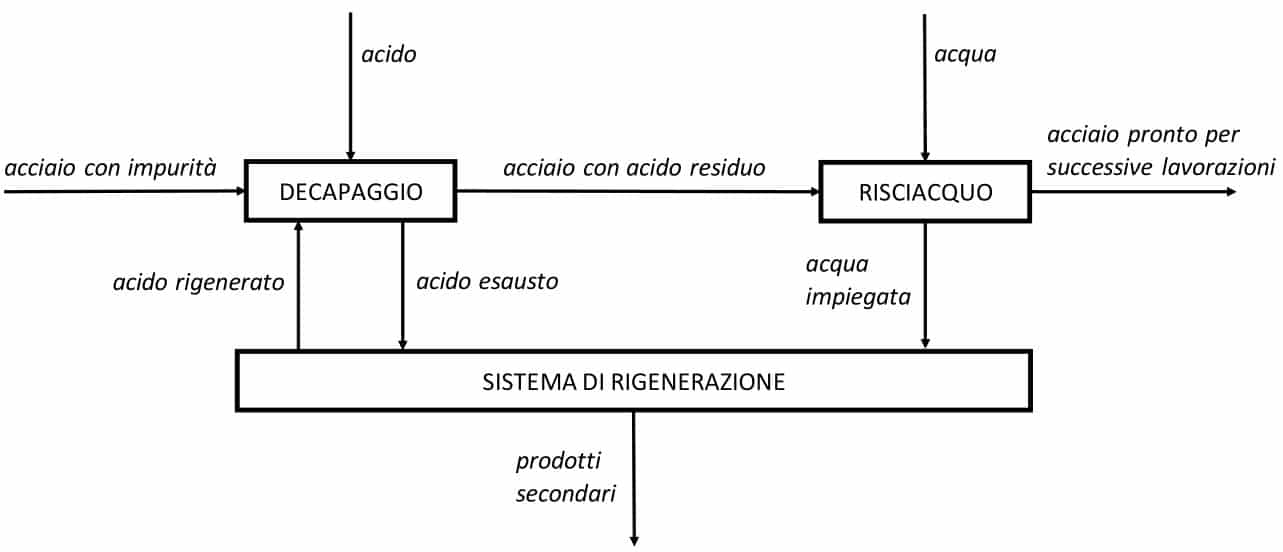
Figura 3 – Fasi di processo del decapaggio
Scelta dei componenti
Nella sezione precedente è stato illustrato il decapaggio. Si rende ora necessaria una panoramica dei fattori di cui tenere conto in fase di progettazione. Innanzitutto, occorre considerare due capacità distinte del sistema: la capacità di output e la capacità chimica. La prima è legata alla quantità di acciaio da gestire ed è un input di progettazione, la seconda esprime invece la quantità di ferro “perso” durante il decapaggio. La massima efficienza si ottiene minimizzando quest’ultimo indicatore. In Tabella 1, sono riportati alcuni dei fattori che incidono sulla capacità chimica.
Tabella 1: Fattori principali per il calcolo del ferro “perso”
| Fattore | Tecnica di controllo per diminuire le quantità di ferro persa |
| Tipologia di impurità da rimuovere | Nessun controllo |
| Quantità di impurità da rimuovere | Nessun controllo |
| Tempo di immersione dell’acciaio | Rimuovere l’acciaio non appena il processo è completo |
| Scelta e dosaggio degli inibitori | Metodi trial and error |
| Componenti e strumentazione del sistema | Attenta analisi dei requisiti e delle condizioni al contorno |
Tra i vari fattori elencati vale la pena soffermarsi sull’ultimo. La scelta dei componenti varia infatti da sistema a sistema in base alla capacità di output da ottenere e ai vincoli economici da rispettare. Tuttavia, occorre evidenziare alcuni aspetti fondamentali in grado di ridurre le perdite e lo spreco di acido.
Ad esempio, i componenti del sistema, tra cui le vasche, le pompe e le valvole, devono garantire un elevato grado di resistenza nei confronti dell’acido. Inoltre, all’interno del processo chimico subentrano una serie di sostanze quali grafite, silice, olii e altri materiali insolubili provenienti dall’acciaio o da strati coprenti (ad es. verniciatura). Complessivamente, i componenti devono dimostrarsi robusti nei confronti di tali sostanze. In questo modo, il processo non registra una riduzione significativa dell’efficienza e lavora in condizioni ideali.




